Energy level
- Elektronenschil of energieniveaus zijn de gespecificeerde afstanden van de kern van een atoom waar elektronen kunnen worden gevonden of de grootste kans om te worden gevonden. Elektronen zijn negatief geladen deeltjes in een molecuul die rond de positieve kern bewegen, meestal in het midden. Energieniveaus lijken enigszins op de metingen van de elektronensprongen van een stap.
- In de meeste fundamentele concepten van een atoom; bestaan uit elektronen die rond een kern draaien.
- De elektronen zijn echter niet in staat om een baan te kiezen volgens hun wens. Elektronen zijn beperkt tot banen met slechts een bepaald energieniveau. Elektronen kunnen alleen van het ene energieniveau of stap naar een ander niveau springen. Elektronen kunnen niet ronddraaien met andere energieën dan de gespecificeerde energieniveaus.
Wat is het energieniveau-diagram?
Energieniveaumiddel voor het evalueren van de hoeveelheid energie die elektronen nodig kunnen hebben en die tijdens de overgang worden vrijgegeven als ze van de ene baan naar de andere springen. De grond- of nultoestand is de minimale energietoestand berekend voor H.2 moleculen.

Wat zijn de vier energieniveaus?
Er zijn vier soorten orbitalen: p, d en f.
- Scherpe-s
- Principe-p
- Diffuus-d
- Fundamenteel-f
In een atoom zijn er enkele combinaties hiervan orbitalen.
Het energieniveau is een hoeveelheid ruimte of regio's, waar dan ook elektronen zal waarschijnlijk aanwezig zijn. Deze afstanden, ook wel orbitalen genoemd, hebben verschillende vormen, aangegeven met een letter (s, p, d, f).

Geek3, Atomaire-orbitale-wolken spdf m0, CC BY-SA 4.0
Hoe bepaal je het energieniveau?

Bruce Blaus, Blausen 0342 ElectronEnergieniveaus, CC BY 3.0
valentie-elektronen
"Elektronen die zich op het hoogste energieniveau bevinden, worden valentie-elektronen genoemd."
Grondtoestand
“De minimale energie-evenwichtstoestand van de H2 atoom wordt erkend als de grondtoestand. "
Opgewonden toestand
Wanneer het elektron (of atoom) een hogere energie heeft dan deze laagste energie, wordt er gezegd dat het in een "aangeslagen toestand" is.
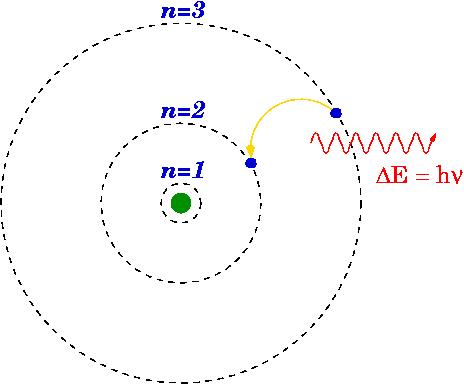
Als een elektron van een hoger niveau naar een lager valt, kan er een foton worden uitgezonden of komt er energie vrij.
Energieverschil
De energie van het uitgezonden foton is het verschil tussen de energieniveaus van de primaire (n i ) en laatste (n f ) staat. De energie van het uitgezonden foton wordt berekend met behulp van de Rydberg-formule.
Het Bohr-model van waterstof
In 1913 bedacht Niels Bohr de energieniveaus en spectrale freqn van de H2 bij het overwegen van verschillende eenvoudige veronderstellingen om de hypothetische klassieke vast te stellen. De meeste van deze tekortkomingen werden opgelost door Arnold Summerfield's modificatie van het Bohr-model. Voor dit model heeft natuurkundige Niels Bohr in 1922 de Nobelprijs voor natuurkunde ontvangen.
In het fundamentele concept dat een atoom (het atoommodel van Bohr), elektronen alleen bepaalde banen rond de kern draaien. De elektronen gaan naar beneden en naar boven tussen toegestane banen, naast de emissie of absorptie van energie.
Hoewel dit basismodel niet goed wordt geaccepteerd omdat de meeste atomenstructuur ingewikkelder is dan waterstof, zijn er wel nieuwe onderwerpen nodig, vandaar de introductie van de kwantummechanica, in de kwantummechanica wordt elk rond elektron verklaard door een wiskundige uitdrukking die bekend staat als een golffunctie.
Willow W., Bohr-atoommodel, CC BY-SA 3.0
Bohrradius
"De Bohr-straal (a0) is een constante parameter, is gelijk aan de meest voorspelbare afstand voor een waterstofatoom tussen de kern en het elektron in de grondtoestand (niet-relativistisch en met een oneindig zwaar proton)"
Het is vernoemd naar Niels Bohr vanwege zijn aandeel in het Bohr-model van een atoom.

SE3-29X, Waterstof GIF, CC BY-SA 4.0
Spectrale lijnen
Elk onderdeel heeft een bepaalde set energieniveaus. De frequenties waarin het licht absorbeert en uitzendt, gedragen zich dus als een soort microfoon en identificeren de specifieke verbinding en het specifieke. Deze kenmerken van atomen hebben onderzoek gedaan in onderwerpen die spectroscopie worden genoemd, een wetenschap die zich toelegt op het identificeren van moleculen en atomen aan de hand van het type straling dat ze absorberen of uitzenden.
Balmer-serie
Atoomfysicus Balmer heeft analytisch een verband opgemerkt in de energieën tijdens het vrijkomen van fotonen uit het atoom. De verschillende afzonderlijke fotonenergieën / golflengten die door Balmer werden ontdekt, worden de Balmer-serie genoemd.
Later werd bekend dat energie-overgangen de Balmer-lijnen creëren vanuit het waterstofatoom. Het Bohr-model van het atoom slaagde erin de Balmer-reeks te spellen omdat grotere banen elektronen nodig hadden om aanzienlijk meer ongunstige kracht of negatieve energie te hebben om in evenwicht te komen met het impulsmoment. De Rydberg-formule biedt een brede kijk op de Balmer-serie voor alle aanpassingen aan het energieniveau.
Emissie spectrum
De emissie spectrum van atomaire waterstof werd verdeeld in talrijke spectrale reeksen en golflengten die werden geleverd door de standaard Rydberg-formule. Deze gedetecteerde spectraallijnen zijn het resultaat van de elektronenovergang van verschillende energieniveaus in een atoom.
Een emissiespectrum geeft de verscheidenheid aan golflengten aan die worden uitgezonden door een atoom of een chemische verbinding die wordt gestimuleerd door verwarming of elektrische stroom. Het emissiespectrum van brandend gas of andere moleculen kan ook worden gebruikt om bijvoorbeeld de samenstelling ervan te bepalen.
Krediet van het beeld: Ranjithsiji, Atoomemissiespectrum van helium, CC BY-SA 4.0
Potentiële energie
“Dit is de energie van een entiteit voor zijn positie ten opzichte van andere objecten, spanningen, opgeslagen elektrische lading of andere factoren in zichzelf. "
Bindende energie
"De bindingsenergie is de minimale energie die nodig is om een kern bij elkaar te houden."
Ionisatieenergie
"De hoeveelheid energie die een geïsoleerd atoom in de elektronische toestand van de aarde nodig had om te worden geabsorbeerd om te worden ontladen als een e- "
Ionisatie-energie wordt beschreven als een moeilijke stap bij het verwijderen van een elektron in een atoom of ion of de vaardigheid van een atoom of ion om een elektron over te geven. Het aantal elektronenreductie vindt meestal plaats in de grondtoestand van de soort.
De ionisatie-energieën worden gemeten in kJ / mol, of de hoeveelheid energie die nodig is om alle atomen in een mol respectievelijk een eenheid e- los te maken.
Hoe werkt ionisatie-energie?
Ionisatie-energie is de energie die nodig is, waarin een geïsoleerd, gasvormig atoom uit de elektronische grondtoestand moet absorberen om een elektron vrij te geven. Hoe meer elektronen verloren gaan, hoe meer + ve dit ion zal zijn, en het zal moeilijker zijn om het e- van het atoom te scheiden.
Welk element heeft de hoogste en laagste ionisatie-energie?
- Het element Hij heeft de hoogste ionisatie-energie.
- Francium heeft de minimale ionisatie-energie.
De ionisatie-energie van een element wordt hoger van links naar rechts over een periodiek systeem en daalt van boven naar beneden in het algemeen in het periodiek systeem.
Cdan en Adrignola, Ionisatie-energie periodiek systeem, CC BY-SA 3.0
Voor meer informatie over elektronenwolk Klik hier
Lees ook:
- Is potentiële energie opgeslagen energie?
- Soorten kinetische energie
- Voorbeeld van elektrische energie naar stralingsenergie
- Voorbeeld van mechanische naar elektrische energie
- Zwaartekrachtenergie naar mechanische energie
- Formule voor windenergie
- Heeft massa invloed op potentiële energie?
- Van stralingsenergie naar chemische energie
- Van chemische energie naar geluidsenergie
- Voorbeeld van kinetische naar geluidsenergie

Ik ben Subrata, Ph.D. in Engineering, meer specifiek geïnteresseerd in domeinen die verband houden met kern- en energiewetenschappen. Ik heb ervaring in meerdere domeinen, van Service Engineer voor elektronische aandrijvingen en microcontrollers tot gespecialiseerd R&D-werk. Ik heb aan verschillende projecten gewerkt, waaronder kernsplijting, fusie met fotovoltaïsche zonne-energie, het ontwerp van verwarmingselementen en andere projecten. Ik heb een grote interesse in het wetenschapsdomein, energie, elektronica en instrumentatie, en industriële automatisering, vooral vanwege het brede scala aan stimulerende problemen die dit vakgebied met zich meebrengt, en dat verandert elke dag door de industriële vraag. Ons doel hier is om deze onconventionele, complexe wetenschappelijke onderwerpen op een eenvoudige en begrijpelijke, to-the-point manier toe te lichten.

Hallo medelezer,
We zijn een klein team bij Techiescience, dat hard werkt tussen de grote spelers. Als je het leuk vindt wat je ziet, deel dan onze inhoud op sociale media. Uw steun maakt een groot verschil. Bedankt!