Hoe Redoxreactie te vinden

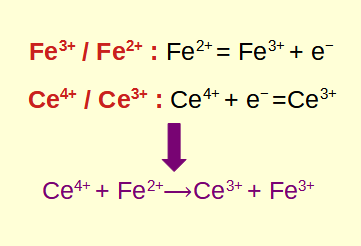

redoxreacties, een afkorting van oxidatie-reductiereacties, zijn fundamentele chemische processen waarbij elektronen tussen reactanten worden overgedragen. Inzicht in het identificeren en berekenen van redoxreacties is cruciaal op het gebied van chemie en biologie. In deze blogpost onderzoeken we de basisprincipes van redoxreacties, leren we hoe we ze kunnen identificeren, verdiepen we ons in de berekeningen die erbij betrokken zijn en verkennen we hun praktische toepassingen.
De basisprincipes van redoxreacties begrijpen
Redoxreacties treden op wanneer er een overdracht van elektronen plaatsvindt tussen twee soorten. De ene soort verliest elektronen (ondergaat oxidatie), terwijl de andere soort elektronen krijgt (ondergaat reductie). Deze overdracht van elektronen wordt aangedreven door een verschil in de elektronegativiteit van de betrokken atomen.
De geoxideerde soort staat bekend als het reductiemiddel omdat het elektronen doneert, terwijl de gereduceerde soort het oxidatiemiddel wordt genoemd omdat het elektronen accepteert. Het is belangrijk op te merken dat redoxreacties altijd zowel oxidatie als reductie met zich meebrengen, vandaar de naam.
Belang van Redoxreacties
redoxreacties spelen een cruciale rol in verschillende chemische en biologische processen. Ze zijn betrokken bij de energieproductie, corrosie, de synthese van chemicaliën en zelfs het functioneren van ons eigen lichaam. Het proces van oxidatieve fosforylering, dat plaatsvindt in de mitochondriën van onze cellen, is bijvoorbeeld afhankelijk van redoxreacties om ATP te produceren, de universele energievaluta van cellen.
Veel voorkomende voorbeelden van redoxreacties
Laten we eens kijken naar enkele veelvoorkomende voorbeelden van redoxreacties:
Verbranding: Wanneer een stof reageert met zuurstof en warmte en licht produceert, is er sprake van een redoxreactie. Bijvoorbeeld het verbranden van hout of de verbranding van benzine in een automotor.
Roesten: Het roestproces omvat de oxidatie van ijzer in aanwezigheid van zuurstof en water. Het ijzer verliest elektronen en vormt ijzer(III)oxide (roest).
Fotosynthese: Tijdens fotosynthese zetten planten kooldioxide en water om in glucose en zuurstof, met behulp van zonlicht. Dit proces omvat de reductie van kooldioxide en de oxidatie van water.
Redoxreacties identificeren
Om een redoxreactie te identificeren, moeten we de stoffen herkennen die oxidatie en reductie ondergaan. Hier volgen enkele belangrijke stappen waarmee we redoxreacties snel kunnen identificeren:
Herkennen van oxidatie en reductie: Zoek naar veranderingen in oxidatietoestanden of het verlies/winst van elektronen. Als de oxidatietoestand van een element toeneemt, wordt het geoxideerd, terwijl een afname van de oxidatietoestand reductie aangeeft.
Bepaling van het oxidatiegetal: Het oxidatiegetal is een concept dat wordt gebruikt om de verdeling van elektronen in een verbinding of ion te bepalen. Het helpt ons de verandering in oxidatietoestanden tijdens een redoxreactie te identificeren.
Redoxreacties snel identificeren: Een effectieve methode om redoxreacties te identificeren is door te zoeken naar de aanwezigheid van bepaalde elementen of verbindingen waarvan bekend is dat ze redoxreacties ondergaan. Waterstofperoxide (H2O2) is bijvoorbeeld een veelgebruikt oxidatiemiddel, terwijl stoffen als natriumboorhydride (NaBH4) reductiemiddelen zijn.
Redoxreacties berekenen
Zodra we een redoxreactie hebben geïdentificeerd, kunnen we doorgaan met het berekenen ervan. Hier is hoe:
De halfreacties vinden: Splits de redoxreactie in twee halfreacties, waarbij de ene oxidatie voorstelt en de andere reductie. Dit helpt bij het later in evenwicht brengen van de vergelijking.
De redoxreactie in evenwicht brengen: breng het aantal atomen aan elke kant van de vergelijking in evenwicht door de coëfficiënten aan te passen. Het is essentieel om zowel massa als lading in evenwicht te brengen bij het omgaan met redoxreacties.
Berekening van de algehele redoxreactie: Combineer de gebalanceerde halfreacties en zorg ervoor dat het aantal gewonnen elektronen bij reductie overeenkomt met het aantal elektronen dat verloren gaat bij oxidatie.
Geavanceerde concepten in redoxreacties
Laten we, om ons begrip van redoxreacties te verdiepen, enkele geavanceerde concepten onderzoeken:
Bepalen van de spontaniteit van redoxreacties: De spontaniteit van een redoxreactie kan worden bepaald met behulp van het concept van redoxpotentiaal. Als het redoxpotentiaal positief is, is de reactie spontaan, wat aangeeft dat de kans groter is dat deze optreedt.
De coëfficiënt van redoxreacties vinden: De coëfficiënten in een gebalanceerde redoxreactie vertegenwoordigen het relatieve aantal mol van elke betrokken soort. Deze coëfficiënten zijn cruciaal voor stoichiometrische berekeningen.
De rol van elektronen in redoxreacties begrijpen: Elektronen zijn de ladingsdragers in redoxreacties. Ze reizen van het reductiemiddel naar het oxidatiemiddel, waardoor de overdracht van energie wordt vergemakkelijkt.
Praktische toepassingen van redoxreacties
Redoxreacties hebben praktische toepassingen in verschillende domeinen. Laten we een paar voorbeelden verkennen:
redoxreacties in het dagelijks leven: Het ademhalingsproces in ons lichaam is afhankelijk van redoxreacties om glucose in energie om te zetten. Bovendien werken de batterijen die we dagelijks gebruiken, zoals alkalibatterijen en lithium-ionbatterijen, op basis van redoxreacties.
Industriële toepassingen van redoxreacties: Redoxreacties zijn cruciaal in industriële processen zoals metaalextractie, galvaniseren en afvalwaterzuivering. Ze helpen schadelijke verontreinigende stoffen te verwijderen en om te zetten in minder giftige stoffen.
redoxreacties in biologische systemen: In het menselijk lichaam zijn redoxreacties betrokken bij verschillende biologische processen, waaronder metabolisme, ontgifting en immuunreacties. Overmatige redoxreacties kunnen echter leiden tot oxidatieve stress, die cellen kan beschadigen en kan bijdragen aan ziekten.
Lees ook:
- Knoevenagel-reactie
- Lichtafhankelijk reactievoorbeeld
- endotherme reactie
- Nucleofiele substitutiereactie
- Voorbeeld van een synthesereactie
- Fotochemische reactie
- Endergonische reactie voorbeeld
- Voorbeeld van een eerste orde reactie
- Lichtonafhankelijk reactievoorbeeld
- Kolbe-reactie

Hallo,
Ik ben Aditi Ray, een chemie-KMO op dit platform. Ik heb mijn diploma scheikunde behaald aan de Universiteit van Calcutta en een postdoctorale opleiding aan de Techno India University met een specialisatie in anorganische chemie. Ik ben erg blij om deel uit te maken van de Lambdageeks-familie en ik wil het onderwerp graag op een simplistische manier uitleggen.
Laten we verbinding maken via LinkedIn-https://www.linkedin.com/in/aditi-ray-a7a946202
