Siliciumtetrafluoride (SiF4) heeft een centraal silicium (Si) atoom met 4 valentie-elektronen, die enkele bindingen vormen met vier fluor (F)-atomen, die elk 7 valentie-elektronen bijdragen. De Lewis-structuur toont vier Si-F-bindingen en geen alleenstaande paren op silicium, met behulp van 8 bindingselektronen. SiF4 neemt een tetraëdrische geometrie aan met verbindingshoeken van ongeveer 109.5°, kenmerkend voor sp³-hybridisatie. Het molecuul is niet-polair vanwege zijn symmetrische vorm, ondanks de hoge elektronegativiteit van fluor (3.98). Deze structuur en de sterkte van de Si-F-bindingen hebben een aanzienlijke invloed op de chemische eigenschappen van SiF4, inclusief de reactiviteit en rol ervan in de halfgeleiderindustrie.

Laten we het volgende punt in dit artikel bespreken:
- hoe de Lewis-structuur te tekenen voor SIF4
- SIF4 lewis structuur eenzame paren
- SIF4 Lewis-structuurvorm:
- SIF4 lewis structuur octet regel
- SIF4-hybridisatie
- SIF4 lewis structuurresonantie
- SIF4 polair of niet-polair
- SIF4 lewis structureert formele ladingen
- SIF4 Lewis-structuurvorm:
hoe de Lewis-structuur te tekenen voor SIF4
De vorm van een molecuul hangt af van de afstoting tussen het valentie-elektronbindingspaar of het niet-bindende paar. In het SIF4-molecuul zijn de vier fluoratomen omgeven door een centraal siliciumatoom. Het siliciumatoom heeft vier ongepaarde elektronen,
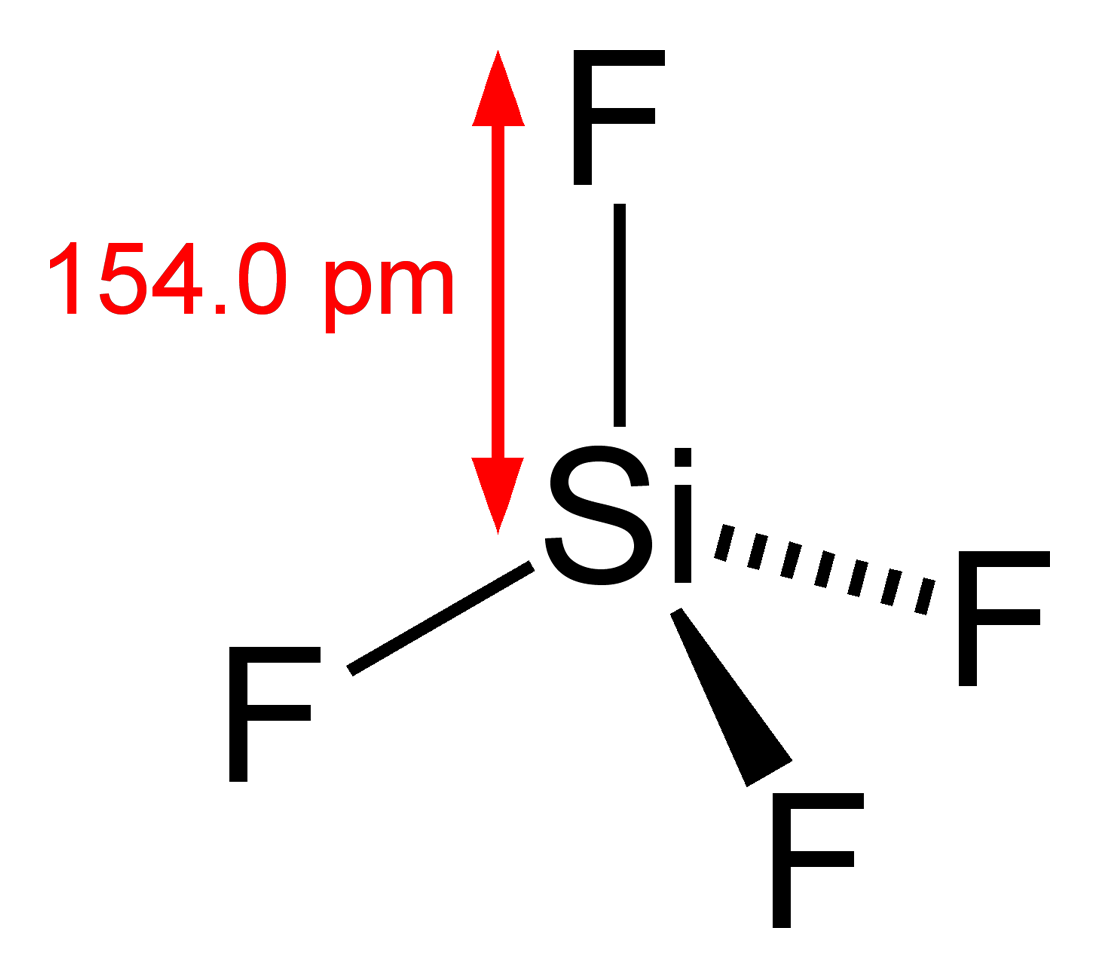
Volgens de octetregel wordt silicium gecombineerd met vier andere atomen om zijn octet te voltooien. Vorm daarom vier Si-F-bindingen. Volgens de VSEPR-theorie vertoont het SiF4-molecuul een tetraëdrische geometrie, met een bindingshoek van 109.5o en obligatielengte van 154 pm.
SIF4 lewis structuur eenzame paren
Valentie-elektron van één siliciumatoom = 4×1=4
Valentie-elektron van vier fluoratomen = 7×4=28
Totale valentie-elektronen = 32 er zijn 16 elektronenparen nodig voor een stabiele Lewis-structuur.
In het bovenstaande structuurtotaal hebben we 16 elektronenparen met vier Si-F-bindingen. Er blijven dus 12 elektronen over die worden aangeduid met alleenstaande paren, voor elk fluoratoom zijn er drie alleenstaande paren, dus in totaal zijn er 12 eenzame elektronenparen rond het silicium atoom,
en silicium heeft een nulpaar van het elektron omdat alle 12 elektronenparen rond het vier fluoratoom aanwezig zijn.
SIF4 Lewis-structuurvorm:

SIF4 lewis structuur octet regel
In bovenstaande Lewis-structuur, silicium en fluor hebben geen ladingen en het centrale siliciumatoom voltooit zijn octet, daarom is deze structuur een stabiele Lewis-structuur. Voor een stabiele Lewis-structuur moeten alle atomen in de aanwezige moleculen voldoen aan de octetregel,
De octetregel stelt dat om een stabiele configuratie te bereiken de valentieschil van een atoom acht elektronen bevat die lijken op een elektronische configuratie van het dichtstbijzijnde edelgas.
In het SiF4-molecuul heeft het fluoratoom slechts één elektron nodig om zijn octet te voltooien, terwijl het siliciumatoom vier elektronen nodig heeft om zijn octet te voltooien en stabiel te worden. silicium- en fluoratoom delen één elektron met elkaar en voltooien hun octet, waterstof heeft twee valentie-elektronen en silicium heeft acht valentie-elektronen, op deze manier voltooien ze hun octet.
SIF4-hybridisatie
Hybridisatie is een proces waarbij de atomaire orbitalen van beide atomen in een molecuul samenkomen en met elkaar combineren om een hybride orbitaal te vormen door een directe overlappende sigma-binding te vormen, terwijl parallelle parallellen elkaar overlappen en een pi-binding vormen.
In SiH4-molecuul is de elektronische configuratie van silicium,
Si: 1s2 2s2 2p6 3s2 3p2
Si: [Ar] 3s2 3p2

Uit het bovenstaande diagram komen de s-orbitaal en de drie p-orbitaal samen en combineren ze om 4 gehybridiseerde 3p te vormen3 orbitalen deze 4 hybride orbitalen vormen vier sigma-bindingen met vier waterstofatomen. Daarom is de hybridisatie voor Si sp3 in SiH4.
SIF4 lewis structuurresonantie
Resonantie is een chemisch fenomeen waarbij de hele eigenschappen van een molecuul niet met één enkele structuur kunnen worden verklaard. Er zijn veel canonieke structuren bij betrokken. Maar niet elk molecuul kan resonantie vertonen.
SiF4 lewis structuur vertoont geen resonantie omdat er geen delokalisatie van elektronen is en er sprake is van enkele bindingen. Er zit dus geen beweging in. Ook al is er de aanwezigheid van eenzame elektronenparen, delokalisatie verstoort de stabiliteitsfactor. Er zijn dus geen resonanties structuren van de SiFl4 lewis structuur
SIF4 polair of niet-polair
De vier fluoratomen zijn omgeven door een centraal siliciumatoom in het SiF4-molecuul, de elektronegativiteit van het siliciumatoom is 1.90 en die van de elektronegativiteit van het fluoratoom is 3.98, het verschil tussen de elektronegativiteit van fluor en silicium is 2.08,
Dit grote verschil in elektronegativiteit tussen silicium en fluor geeft aan dat de elektronenparen sterk worden aangetrokken door het fluoratoom, vandaar dat de Si-F-binding in het SiF4-molecuul polair is. het grotere elektronegativiteitsverschil tussen hen geeft aan dat het elektronenpaar sterk wordt aangetrokken door het fluoratoom en dat de Si-F-binding dus zeer polair is.
SIF4 lewis structureert formele ladingen
In siliciumtetrafluoridemolecuul komt het aantal werkelijke ladingen overeen met de totale formele ladingen. De formele kosten worden berekend door de SiF4 Lewis-puntstructuur. Die worden berekend met de volgende formule,
De formele lading op Si-atoom van SiF4-molecuul = valentie-elektron van Silonepaar van silicium -1/2 (bindingspaar van elektronen)
Volgens de formele formule voor het berekenen van de lading heeft het siliciumatoom 4 valentie-elektronen, acht bindingselektronen en geen eenzaam paar. vandaar, in SiF4-molecuul Daarom, formele lading op siliciumatoom van SiF4-molecuul = (4-0-(8/2)) =0
Vandaar dat de formele ladingen in het SiF4-molecuul nul zijn.
SIF4 Lewis-structuurvorm:
Tetraëdrische structuur van SiF4 Hieronder weergegeven:
Veelgestelde Vragen / FAQ
Wat is de Lewis-structuur van SiF4?
Antwoord: In de Lewis-structuur van SiF4-molecuul centraal siliciumatoom is omgeven door vier fluoratomen, het vormt vier Si-F-bindingen, alle fluoratomen hebben drie eenzame paren op elk.
Wat zijn de overeenkomsten en verschillen tussen de Lewis-structuren van XeO3 en SIF4?
De xeo3 lewis-structuur uitgelegd onthult dat zowel XeO3 als SiF4 centrale atomen hebben omgeven door elektronenparen en bindingsparen. Het belangrijkste verschil ligt echter in het aantal elektronenparen en bindingshoeken. XeO3 heeft 3 bindingsparen en 2 alleenstaande paren, wat resulteert in een trigonale piramidevorm met bindingshoeken van ongeveer 109.5°. Aan de andere kant heeft SiF4 4 bindingsparen en geen alleenstaande paren, waardoor het een tetraëdrische vorm heeft met bindingshoeken van 109.5 °.
Hoe voorspel je de vorm van SiF4?
Antwoord: De vorm van SiF4 wordt voorspeld door de VSEPR-theorie. Het centrale siliciumatoom heeft vier valentie-elektronen en is daarom verbonden met vier fluoratomen en vormt een tetraëdrische geometrie.
Wat is de betekenis van Lewis-structuur?
Antwoord: Het definieert de aard van binding en positie van atomen van het molecuul die in het molecuul zijn verbonden. De weergave van moleculen in een Lewis-elektronenpuntstructuur of gewoon een Lewis-structuur is ter ere van de Amerikaanse chemicus Gilbert Newton Lewis.
Lees ook:
- Ncl2 Lewis-structuur
- Co2 Lewis-structuur
- Bao Lewis-structuur
- Sncl2 Lewis-structuur
- H2so4 Lewis-structuur
- Xecl2 Lewis-structuur
- Chf3 Lewis-structuur
- Na2so4 lewis-structuur
- Bf3 Lewis-structuur
- H2o2 Lewis-structuur

Hallo….Ik ben Darshana Fendarkar, ik heb mijn Ph.D. van de Universiteit van Nagpur. Mijn specialisatiegebied is Anorganische Chemie.
Ik heb ervaring als chemicus bij Earthcare Pvt. Ltd. Ook heb ik 2 jaar ervaring in lesgeven. Momenteel werk ik samen met Lambdageek als Subject Matter Expert.

